신물질 'CDg16'로 명명, 동물실험으로 효능 확인
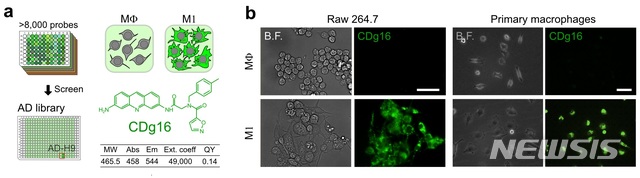
【대전=뉴시스】김양수 기자 = IBS 연구진은 자체 개발한 8200여 개의 형광 유기 분자 라이브러리를 스크리닝해 활성화대식세포를 선택적으로 염색할 수 있는 새로운 형광물질 CDg16을 발견했다(그림a). 그림 b는 세포주 및 동물유래 활성화대식세포가 CDg16에 의해 염색되는 모습.2019.03.07(사진=IBS 제공) [email protected]
【대전=뉴시스】김양수 기자 = 국내 연구진이 동맥경화 진단의 정확성을 높일 수 있는 새로운 형광물질을 발견했다.
기초과학연구원(IBS)은 복잡계자기조립연구단 장영태 부연구단장 팀이 IBS 유전체교정연구단의 김진수 수석연구위원 팀, 싱가포르 연구진 등과 국제 공동연구를 통해 활성화대식세포만을 선택적으로 염색하는 형광물질 'CDg16(Compound Designation green 16)'을 발견했다고 7일 밝혔다.
연구팀에 따르면 체내 침입물질을 감지했을 때 대식세포가 활성화대식세포로 분화하며 항원을 만들어내기 때문에 체내 면역을 담당하는 대식세포(macrophage)는 염증반응의 신호탄으로 불린다.
이로 활성화대식세포를 얼마나 정확히 검출해낼 수 있는지가 염증질환의 정확한 진단 및 치료의 관건이 된다.
하지만 활성화대식세포만을 선택적으로 염색하는 탐지기(probe) 개발은 쉽지 않아 기존 개발된 형광분자들은 생체 내 활용이 어려워 살아있는 조직에서 활성화대식세포를 선별하는 데 한계가 있었다.
이번 공동연구에서 장영태 부연구단장 팀은 자체개발한 8200여 종류의 형광 유기 분자 라이브러리를 탐색해 활성화대식세포만을 선택적으로 염색하는 화합물을 찾아내고 CDg16이라 이름붙였다.
또 CDg16이 활성화대식세포 내 세포소기관인 리소좀을 염색하고 세포독성이 거의 없다는 사실도 확인했다.
이어 동맥경화 생쥐의 꼬리정맥으로 CDg16을 주사한 뒤 면역화학염색법을 통한 CDg16의 효능 검증을 진행해 CDg16이 생쥐의 죽상경화판에서 활성화대식세포를 선택적으로 염색한다는 사실을 증명했다.
이는 실험에 이용된 생쥐의 경우 동맥 내 콜레스테롤이 침착하거나 혈전이 축적되며 생기는 죽상경화판이 동맥경화를 유발한 정확한 염증부위라는 의미다.
연구진은 다른 탐지기들과 달리 이번에 개발한 CDg16은 특정한 결합단백질이 없어도 세포 내에서 운반된다는 사실도 확인했다.
이와 함께 연구진은 우리 몸 속 세포에 약 450개 가량 존재하는 막운반체 중 물질을 세포내로 운반하는 SLC 단백질에 CDg16을 전달하는 시스템이 있을 것으로 보고 규명작업에 착수했다.
규명작업을 위해 IBS 유전체 교정 연구단과 함께 추가 실험을 진행, 특정 유전자 발현을 활성화시킬 수 있는 활성크리스퍼 시스템(CRISPRa system)을 활용해 380여 개의 SLC 유전자를 무작위하게 과발현시킨 뒤 RNA 염기서열 분석을 통해 SLC18B1 유전자가 CDg16 염색에 관여한다는 메커니즘을 새로 규명했다.
장영태 박사는 "기존 탐지기들처럼 특정 단백질 하나와 결합해 선택성을 획득하는 것이 아니라 활성대식세포에서 과발현된 SLC18B1 막운반체를 통해 CDg16이 활성화대식세포에 직접 들어가서 염색한다는 사실을 찾아냈다"며 "한 단백질 타겟에 하나씩 붙는 기존 방식에 비해 막운반체는 다수의 탐지기를 수송할 수 있어 뚜렷한 신호를 관찰할 수 있다는 장점이 있다"고 설명했다.
장 박사는 “연구단 간 공동연구를 토대로 고속효율 스크리닝과 유전자 조작 기술을 결합한 결과 이같은 성과를 올릴 수 있었다"면서 "활성화대식세포를 선택적으로 염색하는 형광물질은 향후 다양한 염증성 질환의 진단 및 약물 개발을 견인할 것"이라고 기대를 나타냈다.
한편 이번 연구결과는 국제학술지 네이처 커뮤니케이션즈(Nature Communications, IF 12.353) 온라인 판에 7일 게재됐다. 논문명은 Imaging inflammation using an activated macrophage probe with Slc18b1 as the activation-selective gating target다.
[email protected]
기초과학연구원(IBS)은 복잡계자기조립연구단 장영태 부연구단장 팀이 IBS 유전체교정연구단의 김진수 수석연구위원 팀, 싱가포르 연구진 등과 국제 공동연구를 통해 활성화대식세포만을 선택적으로 염색하는 형광물질 'CDg16(Compound Designation green 16)'을 발견했다고 7일 밝혔다.
연구팀에 따르면 체내 침입물질을 감지했을 때 대식세포가 활성화대식세포로 분화하며 항원을 만들어내기 때문에 체내 면역을 담당하는 대식세포(macrophage)는 염증반응의 신호탄으로 불린다.
이로 활성화대식세포를 얼마나 정확히 검출해낼 수 있는지가 염증질환의 정확한 진단 및 치료의 관건이 된다.
하지만 활성화대식세포만을 선택적으로 염색하는 탐지기(probe) 개발은 쉽지 않아 기존 개발된 형광분자들은 생체 내 활용이 어려워 살아있는 조직에서 활성화대식세포를 선별하는 데 한계가 있었다.
이번 공동연구에서 장영태 부연구단장 팀은 자체개발한 8200여 종류의 형광 유기 분자 라이브러리를 탐색해 활성화대식세포만을 선택적으로 염색하는 화합물을 찾아내고 CDg16이라 이름붙였다.
또 CDg16이 활성화대식세포 내 세포소기관인 리소좀을 염색하고 세포독성이 거의 없다는 사실도 확인했다.
이어 동맥경화 생쥐의 꼬리정맥으로 CDg16을 주사한 뒤 면역화학염색법을 통한 CDg16의 효능 검증을 진행해 CDg16이 생쥐의 죽상경화판에서 활성화대식세포를 선택적으로 염색한다는 사실을 증명했다.
이는 실험에 이용된 생쥐의 경우 동맥 내 콜레스테롤이 침착하거나 혈전이 축적되며 생기는 죽상경화판이 동맥경화를 유발한 정확한 염증부위라는 의미다.
연구진은 다른 탐지기들과 달리 이번에 개발한 CDg16은 특정한 결합단백질이 없어도 세포 내에서 운반된다는 사실도 확인했다.
이와 함께 연구진은 우리 몸 속 세포에 약 450개 가량 존재하는 막운반체 중 물질을 세포내로 운반하는 SLC 단백질에 CDg16을 전달하는 시스템이 있을 것으로 보고 규명작업에 착수했다.
규명작업을 위해 IBS 유전체 교정 연구단과 함께 추가 실험을 진행, 특정 유전자 발현을 활성화시킬 수 있는 활성크리스퍼 시스템(CRISPRa system)을 활용해 380여 개의 SLC 유전자를 무작위하게 과발현시킨 뒤 RNA 염기서열 분석을 통해 SLC18B1 유전자가 CDg16 염색에 관여한다는 메커니즘을 새로 규명했다.
장영태 박사는 "기존 탐지기들처럼 특정 단백질 하나와 결합해 선택성을 획득하는 것이 아니라 활성대식세포에서 과발현된 SLC18B1 막운반체를 통해 CDg16이 활성화대식세포에 직접 들어가서 염색한다는 사실을 찾아냈다"며 "한 단백질 타겟에 하나씩 붙는 기존 방식에 비해 막운반체는 다수의 탐지기를 수송할 수 있어 뚜렷한 신호를 관찰할 수 있다는 장점이 있다"고 설명했다.
장 박사는 “연구단 간 공동연구를 토대로 고속효율 스크리닝과 유전자 조작 기술을 결합한 결과 이같은 성과를 올릴 수 있었다"면서 "활성화대식세포를 선택적으로 염색하는 형광물질은 향후 다양한 염증성 질환의 진단 및 약물 개발을 견인할 것"이라고 기대를 나타냈다.
한편 이번 연구결과는 국제학술지 네이처 커뮤니케이션즈(Nature Communications, IF 12.353) 온라인 판에 7일 게재됐다. 논문명은 Imaging inflammation using an activated macrophage probe with Slc18b1 as the activation-selective gating target다.
[email protected]





